2020
El granado nuevo hesped del virus passiflora edulis symptomless virus (Autora: A.B. Ruiz-García)
25/11/20 09:41 ..... Divulgacion
En uno de nuestros trabajos recientes (Caglayan, K.; Gazel, M.; Roumi, V.; Kocabag, H.D.; Tunç, B.; Reynard, J.S.; Ruiz-García, A.B.; Olmos, A. & Candresse, T. 2020. Identification of Pomegranate as a New Host of Passiflora Edulis Symptomless Virus (PeSV) and Analysis of PeSV Diversity. Agronomy 2020, 10, 1821) hemos identificado el virus pastaflora edulis symptomless virus (PeSV) en plantas de granado son sintomatología similar a la que produce el virus de la sharka. PeSV ha sido propuesto recientemente como un nuevo miembro de la familia Potiviridae, dentro del género Roymovirus. El genoma de las dos especies descritas de este género, rose yellow mosaic virus y PeSV muestran peculiaridades respecto a otros potyvirus, en particular, un sitio adicional de escisión de NIa-Pro en la proteína 6K2-NIa-VPg, la ausencia de motivos de transmisión de áfidos tanto en HC-Pro como en CP, así como la presencia de un supuesto motivo de transmisión de ácaros en la CP.

Figura 1: Síntomas producidos por la infección causada por PeSV en granado. Anillos cloróticos, clorosis nervial y anillos cloróticos a lo largo de las nervaduras centrales.
La estructura genómica de diversos aislados del virus se han obtenido y es común la confección de diferentes variantes virales en el mismo árbol.

Figura 2. Genoma del aislado (PeSV)-PS1-5.
Además en este estudio, se realizó microscopio electrónica y se observaron partículas similares a las de los potyvirus. Se emplearon plantas de granado sintomáticas para extraer los viriones. Los viriones que se observaron eran filamentos flexibles y con una longitud de entre 760 a 780 nm y de 11 a 20 nm de ancho, con simetría helicoidal.
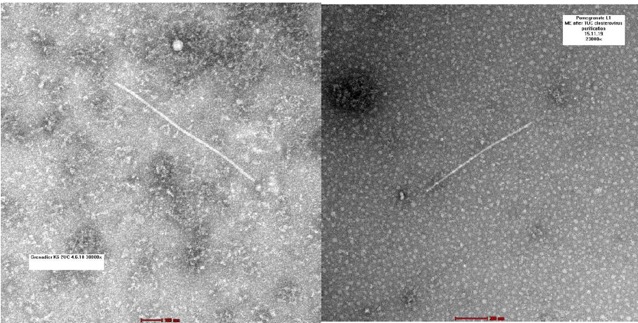
Figura 3. Microscopía electrónica empleando un microscopio de transmisión. La escala corresponde a 100nm en la fotografía de la izquierda y a 200 nm en la de la derecha.

Figura 1: Síntomas producidos por la infección causada por PeSV en granado. Anillos cloróticos, clorosis nervial y anillos cloróticos a lo largo de las nervaduras centrales.
La estructura genómica de diversos aislados del virus se han obtenido y es común la confección de diferentes variantes virales en el mismo árbol.

Figura 2. Genoma del aislado (PeSV)-PS1-5.
Además en este estudio, se realizó microscopio electrónica y se observaron partículas similares a las de los potyvirus. Se emplearon plantas de granado sintomáticas para extraer los viriones. Los viriones que se observaron eran filamentos flexibles y con una longitud de entre 760 a 780 nm y de 11 a 20 nm de ancho, con simetría helicoidal.

Figura 3. Microscopía electrónica empleando un microscopio de transmisión. La escala corresponde a 100nm en la fotografía de la izquierda y a 200 nm en la de la derecha.
Comments
Apple stem pitting virus, un virus de amplia distribución y que infecta diversas especies vegetales (Autora: A.B. Ruiz-García)
18/11/20 13:28 ..... Divulgacion
Apple stem pitting virus es un virus que está presente a nivel mundial y se ha descrito infectando manzano, peral, espino, membrillo y cerezo. A pesar de haber sido relacionado con problemas como epinastia, o punteaduras en madera en manzano, amarilleamiento de nervaduras o manchas necrosantes en pera y deformaciones en frutos de membrillo, de forma mucho más frecuente se ha relacionado a infecciones asintomáticas. Diversos estudios han visto la enorme variabilidad genética de este virus, y esta variabilidad se ha propuesta como la causa de su facilidad de adaptación a nuevos huéspedes.
En un estudio realizado en nuestro laboratorio en una prospección de níspero en la región de Segorbe, hemos detectado unas variantes capaces de infectar el níspero aunque sin producir sintomatología.
Para avanzar en el conocimiento y poder disponer de herramientas de diagnóstico de estas variantes de níspero, se ha secuenciado completamente un aislado y caracterizamos parcialmente 10 aislados más para ver filogenéticamente donde se situaban.
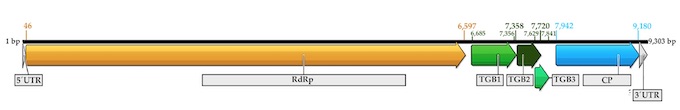
La estructura del aislado de níspero muestra que mantiene los cinco ORFs (RdRP, TGB1, TGB2, TGB3 y CP) como se muestra en la figura
El análisis filogenético del aislado completo de ASPV lo sitúa próximo a las variantes de peral en color verde.
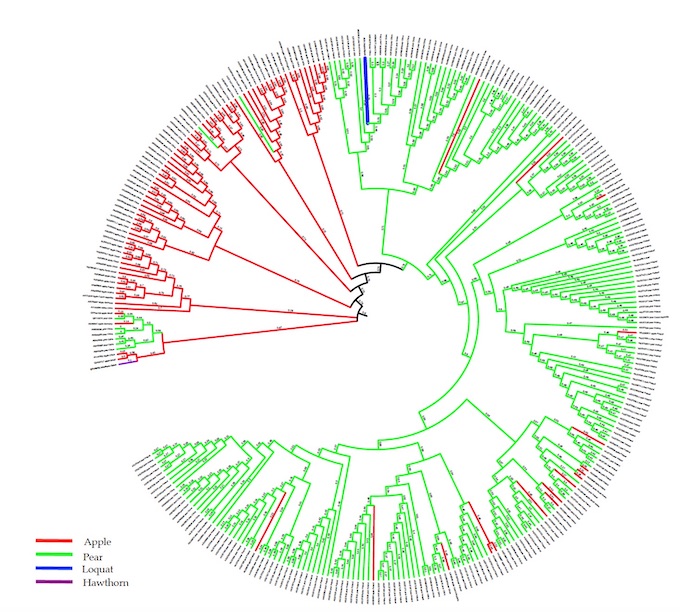
El níspero se confirma como nuevo huésped de ASPV y se han diseñado iniciadores adaptados a la secuencia del aislado del níspero que ha permitido evaluar la prevalencia en Segorbe que ha resultado ser del 15%.
En un estudio realizado en nuestro laboratorio en una prospección de níspero en la región de Segorbe, hemos detectado unas variantes capaces de infectar el níspero aunque sin producir sintomatología.
Para avanzar en el conocimiento y poder disponer de herramientas de diagnóstico de estas variantes de níspero, se ha secuenciado completamente un aislado y caracterizamos parcialmente 10 aislados más para ver filogenéticamente donde se situaban.
La estructura del aislado de níspero muestra que mantiene los cinco ORFs (RdRP, TGB1, TGB2, TGB3 y CP) como se muestra en la figura

El análisis filogenético del aislado completo de ASPV lo sitúa próximo a las variantes de peral en color verde.

El níspero se confirma como nuevo huésped de ASPV y se han diseñado iniciadores adaptados a la secuencia del aislado del níspero que ha permitido evaluar la prevalencia en Segorbe que ha resultado ser del 15%.
Un misterio resuelto, el virus asociado al amarilleamiento de la hoja del olivo aporta datos clave para la creación de un nuevo género en la familia Closteroviridae, para el que se propone el nombre Olivavirus (Autora: A.B. Ruiz-García)
17/10/20 21:02 ..... Divulgacion
En la reciente publicación que tenemos (Ruiz-García, A.B.; Candresse, T.; Canales, C.; Morán, F.; Machado de Oliveira, C.; Bertolini, E.; Olmos, A. Molecular Characterization of the Complete Coding Sequence of Olive Leaf Yellowing-Associated Virus. Plants 2020, 9, 1272. https://doi.org/10.3390/plants9101272) se ha avanzado en el conocimiento del virus asociado al amarilleamiento de la hoja del olivo (OLYaV) y aporta información clave para la creación de un nuevo género en la familia Closteroviridae para el que se propone el nombre de Olivavirus.
El virus asociado al amarilleamiento de la hoja del olivo (OYLaV) se describió por primera vez en 1999, en Italia, en olivos de la variedad Biancolilla. Estos olivos mostraban decoloraciones del verde en las hojas, y tenían una coloración amarillo brillante. Sin embargo sólo se logró una caracterización parcial de un gen (HSP70) pero esta pequeña secuencia permitió que pudiera ser asignado a la familia Closteroviridae.
Estudios posteriores sólo avanzaron parcialmente en su conocimiento del genoma, ya que únicamente se logró conocer alrededor de 5000 nucleótidos. Con este conocimiento se diseñaron técnicas de diagnóstico y se averiguó que OLYaV era uno de los virus del olivo más extendidos en muchas zonas donde se cultivaba. Así, se descubrieron diferentes niveles de incidencia: California (EE. UU.) (93%), Italia (64-21%), Túnez (49%), Líbano (24%), Siria (15%), Grecia (5%) y Albania (2%).
Sin embargo OLYaV permanecía como una especie no asignada en la familia Closteroviridae porque se necesitaban más datos biológicos y moleculares para su clasificación.
En un estudio que recientemente hemos publicado, hemos descubierto la secuencia completa de OYLaV de 16700 nucleótidos, incluyendo todo su potencial de codificación.
En la figura se muestra la organización genómica de OLYaV. L-Pro: proteasa leader papain-like; Met-T: dominio metal transferasa; Helicase: dominio de la helicasa viral; RdRp: polimerasa RNA dependiente; Las flechas azules indican la posición de corte del proteasa.
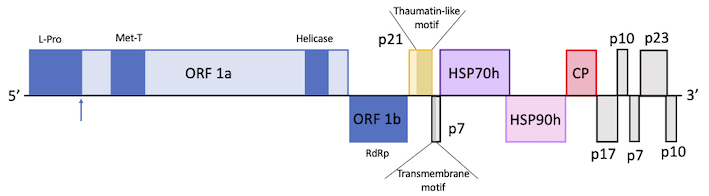
La secuencia completa muestra un genoma con estructura típica de la familia Closteroviridae. Contiene 11 pautas de lectura abiertas (ORF,) entre ellos el complejo ORF1ab que codifica para los tres dominios conservados típicos, proteasa líder similar a la papaína, metiltransferasa y helicasa y además la RdRp, además de los genes de las proteínas HSP70 y HSP90.
OLYaV exhibe dos características genómicas originales. Primero, la ORF2 codifica una proteína similar a la taumatina y segundo, no codifica una proteína CPm. Curiosamente, estas dos características genómicas son compartidas por otras dos especies de Closteroviridae no asignadas, PVB and AV1. Además el análisis filogenético, fundamentalmente el estudio de los genes comunes en todas las especies de closterovirus (ORF1a, ORF1b (RdRp), HSP70, HSP90 y CP) ha abierto nuevas posibilidades en la clasificación taxonómica de OLYaV y del persimmon virus B (PVB) y el actidinia virus 1 (AV1), lo que sugiere de forma consistente que forman un nuevo género dentro de la familia Closteroviridae.
El virus asociado al amarilleamiento de la hoja del olivo (OYLaV) se describió por primera vez en 1999, en Italia, en olivos de la variedad Biancolilla. Estos olivos mostraban decoloraciones del verde en las hojas, y tenían una coloración amarillo brillante. Sin embargo sólo se logró una caracterización parcial de un gen (HSP70) pero esta pequeña secuencia permitió que pudiera ser asignado a la familia Closteroviridae.
Estudios posteriores sólo avanzaron parcialmente en su conocimiento del genoma, ya que únicamente se logró conocer alrededor de 5000 nucleótidos. Con este conocimiento se diseñaron técnicas de diagnóstico y se averiguó que OLYaV era uno de los virus del olivo más extendidos en muchas zonas donde se cultivaba. Así, se descubrieron diferentes niveles de incidencia: California (EE. UU.) (93%), Italia (64-21%), Túnez (49%), Líbano (24%), Siria (15%), Grecia (5%) y Albania (2%).
Sin embargo OLYaV permanecía como una especie no asignada en la familia Closteroviridae porque se necesitaban más datos biológicos y moleculares para su clasificación.
En un estudio que recientemente hemos publicado, hemos descubierto la secuencia completa de OYLaV de 16700 nucleótidos, incluyendo todo su potencial de codificación.
En la figura se muestra la organización genómica de OLYaV. L-Pro: proteasa leader papain-like; Met-T: dominio metal transferasa; Helicase: dominio de la helicasa viral; RdRp: polimerasa RNA dependiente; Las flechas azules indican la posición de corte del proteasa.

La secuencia completa muestra un genoma con estructura típica de la familia Closteroviridae. Contiene 11 pautas de lectura abiertas (ORF,) entre ellos el complejo ORF1ab que codifica para los tres dominios conservados típicos, proteasa líder similar a la papaína, metiltransferasa y helicasa y además la RdRp, además de los genes de las proteínas HSP70 y HSP90.
OLYaV exhibe dos características genómicas originales. Primero, la ORF2 codifica una proteína similar a la taumatina y segundo, no codifica una proteína CPm. Curiosamente, estas dos características genómicas son compartidas por otras dos especies de Closteroviridae no asignadas, PVB and AV1. Además el análisis filogenético, fundamentalmente el estudio de los genes comunes en todas las especies de closterovirus (ORF1a, ORF1b (RdRp), HSP70, HSP90 y CP) ha abierto nuevas posibilidades en la clasificación taxonómica de OLYaV y del persimmon virus B (PVB) y el actidinia virus 1 (AV1), lo que sugiere de forma consistente que forman un nuevo género dentro de la familia Closteroviridae.
Primera detección del Grapevine asteroid mosaic associated virus en viñas de Tempranillo y Macabeo en España (Autora: A.B. Ruiz-García)
27/09/20 22:13 ..... Divulgacion
El virus asociado al mosaico asteroide de la vid (GAMaV) pertenece al género Marafivirus de la familia Tymoviridae. GAMaV se encontró por primera vez infectando una vid en California y posteriormente se descubrió en Japón, Canadá, Uruguay, Francia, Hungría e Italia. En julio de 2019 una muestra de vid de la variedad Tempranillo (TS1), recogida durante uno de nuestros muestreos aleatorios en al D.O. Utiel-Requena, y que mostraba moteado clorótico y deformación en hojas, se analizó por secuenciación masiva (HTS). El análisis de esta muestra mostró que estaba infectada por diversos virus y viroides (grapevine rupestris stem pitting-associated virus, grapevine leafroll-associated virus 3, grapevine virus A, grapevine fleck virus, grapevine red globe virus, grapevine rupestris vein feathering virus y hop stunt viroid).
Además de estos se descubrió la presencia del virus asteroide de la vid y la secuencia completa se recuperó siendo de 6692 nucletótidos. El análisis filogenético mostró que el aislado español se situaba en un clado diferente a los que previamente estaban descritos, como se muestra en la figura.
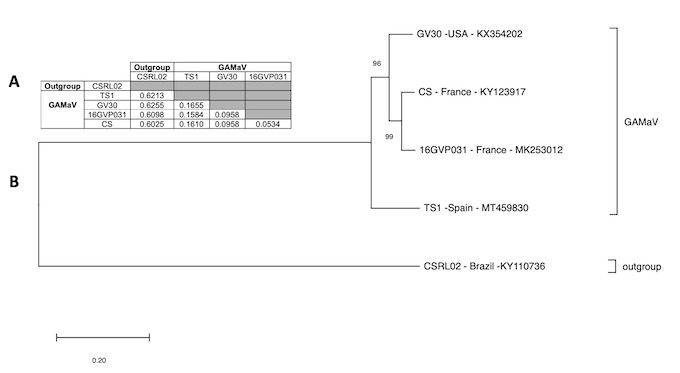
Basándonos en la secuencia del aislado TS1 diseñamos dos iniciadores - GAMaV-6010F, 5’CCCTCCTCCTAGCGACGACC3’ y GAMaV- 6426R, 5’GGGTTGAGACGGCGGAGATC3’ - que amplifican un fragmento de 417 nt en la región de la cáspida y que ha permitido detectar los aislados españoles con fiabilidad, revelando una incidencia en el area estudiada de casi el 10%, puesto que los análisis con los iniciadores descritos por otros autores no detectaban los españoles. Estas han sido las primeras detecciones en España de este virus.
Además de estos se descubrió la presencia del virus asteroide de la vid y la secuencia completa se recuperó siendo de 6692 nucletótidos. El análisis filogenético mostró que el aislado español se situaba en un clado diferente a los que previamente estaban descritos, como se muestra en la figura.

Basándonos en la secuencia del aislado TS1 diseñamos dos iniciadores - GAMaV-6010F, 5’CCCTCCTCCTAGCGACGACC3’ y GAMaV- 6426R, 5’GGGTTGAGACGGCGGAGATC3’ - que amplifican un fragmento de 417 nt en la región de la cáspida y que ha permitido detectar los aislados españoles con fiabilidad, revelando una incidencia en el area estudiada de casi el 10%, puesto que los análisis con los iniciadores descritos por otros autores no detectaban los españoles. Estas han sido las primeras detecciones en España de este virus.
Clasificación de virus vegetales de doble cadena de RNA (Autora: A.B. Ruiz-García)
18/07/20 19:23 ..... Divulgacion
Hay algunos virus de RNA de doble cadena que infectan plantas que se clasifican fundamentalmente en:
Familia Amalgaviridae
Familia Partitiviridae
Familia Reoviridae
Subfamilia Spinareovirinae
Subfamilia Sedoreovirinae
Familia Amalgaviridae
- Género
- Amalgavirus
Familia Partitiviridae
- Géneros
- Alphapartitivirus
- Betapartitivirus
- Deltapartitivirus
Familia Reoviridae
Subfamilia Spinareovirinae
- Géneros
- Fijivirus
- Oryzavirus
Subfamilia Sedoreovirinae
- Género
- Phytoreovirus
Muestreo para el virus de la sharka (Autora: A.B. Ruiz-García)
22/06/20 18:26 ..... Divulgacion
El muestreo debe tener en cuenta la biología del virus y las condiciones climáticas locales, en particular las condiciones del tiempo durante la temporada de crecimiento
Se han de tomar si es posible muestras con síntomas típicos: flores, hojas y frutos que presenten los síntomas
En caso de ser muestras sin síntomas: brotes de por lo menos un año con hojas maduras o completamente desarrolladas de la parte central de cada una de las ramas principales (la detección no es fiable en brotes de menos de un año). Las muestras deberían tomarse, como mínimo, en cuatro sitios diferentes (p. ej., cuatro ramas o cuatro hojas) de cada planta; esto es indispensable ya que la distribución del PPV es desigual
El muestreo no debería realizarse durante los meses de temperaturas más altas
Las pruebas son menos fiables si se realizan con muestras tomadas durante el otoño que con las obtenidas al principio de la primavera
Se han de tomar si es posible muestras con síntomas típicos: flores, hojas y frutos que presenten los síntomas
En caso de ser muestras sin síntomas: brotes de por lo menos un año con hojas maduras o completamente desarrolladas de la parte central de cada una de las ramas principales (la detección no es fiable en brotes de menos de un año). Las muestras deberían tomarse, como mínimo, en cuatro sitios diferentes (p. ej., cuatro ramas o cuatro hojas) de cada planta; esto es indispensable ya que la distribución del PPV es desigual
El muestreo no debería realizarse durante los meses de temperaturas más altas
Las pruebas son menos fiables si se realizan con muestras tomadas durante el otoño que con las obtenidas al principio de la primavera
En primavera, las muestras pueden ser flores, brotes con las hojas totalmente desarrolladas o frutos.
En verano y en otoño pueden utilizarse para el análisis las hojas maduras y la piel de los frutos maduros recogidos del campo o de los lugares de embalaje.
Las flores, las hojas, los brotes y la piel del fruto pueden almacenarse a una temperatura de 4ºC por no más de 10 días antes del procesamiento.
Los frutos pueden almacenarse durante un mes a una temperatura de 4ºC antes del procesamiento.
En invierno pueden seleccionarse las yemas dormidas o los tejidos de corteza de la zona basal de ramillas, brotes y ramas, o espolones enteros.
La psorosis de los cítricos severa transmisible B (Autora: A.B. Ruiz-García)
08/05/20 17:29 ..... Divulgacion
La psoriasis o psorosis severa transmisible es una de las enfermedades de cítricos que no están presentes en España y causa la muerte de árboles en muchas regiones de Argentina, siendo una amenaza a los países productores. De hecho en Argentina la psoriasis severa muestra que tras 15 años después de plantar el 35% de las plantas originalmente sanas tiene síntomas foliares y el 16% lesiones en la corteza y concretamente en pomelo el 49% tienen síntomas y el 21% lesiones en corteza.
La psoriasis severa transmisible o Psoriasis B se encuentra en Argentina y en Uruguay y está ausente en la región EPPO.
La transmisión se ha asociado por un lado al hongo Olpidoium brassiacae
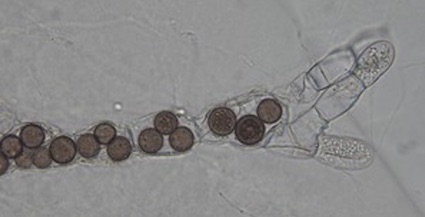
Síntomas
Presencia de descamaciones en la corteza del tronco y ramas
Los síntomas se inician cuando el árbol tiene de 10-15 años con pequeñas lesiones en la corteza
Las lesiones se levantan, se secan y se van desprendiendo
La psorosis B causa descamamiento exuberante en ramas delgadas de los árboles incluso en ramas de menos de 1cm de diámetro

Otras características son que algunas lesiones exudan goma en los límites de las zonas descamadas y en corte transversal de ramas afectadas en la madera se observan zonas de color pardo y de forma irregular que son exudaciones de goma que invaden los vasos de xilema.

La psoriasis severa transmisible o Psoriasis B se encuentra en Argentina y en Uruguay y está ausente en la región EPPO.
La transmisión se ha asociado por un lado al hongo Olpidoium brassiacae

Síntomas
Presencia de descamaciones en la corteza del tronco y ramas
Los síntomas se inician cuando el árbol tiene de 10-15 años con pequeñas lesiones en la corteza
Las lesiones se levantan, se secan y se van desprendiendo
La psorosis B causa descamamiento exuberante en ramas delgadas de los árboles incluso en ramas de menos de 1cm de diámetro

Otras características son que algunas lesiones exudan goma en los límites de las zonas descamadas y en corte transversal de ramas afectadas en la madera se observan zonas de color pardo y de forma irregular que son exudaciones de goma que invaden los vasos de xilema.

Primeras infecciones mixtas en cerezo por diferentes genotipos del virus de la cereza pequeña (Autora: A.B. Ruiz-García)
27/04/20 14:33 ..... Divulgacion
El virus de la cereza pequeña (Little cherry virus 1 - LChV-1) es un miembro del género Velarivirus de la familia Closteroviridae y tiene importancia en el cultivo del cerezo, ya que se ha asociado a diferentes desórdenes en la planta como enanismo o el síndrome Shirofugen. En el año 2016, nuestro equipo de investigación realizó las primeras detecciones en España de este virus, empleando la tecnología de la secuenciación masiva (high throughput sequencing -HTS), que permitió mediante el análisis de pequeños RNAs interferentes la recuperación completa de la secuencia genómica de dos aislados del virus (KX192366 - aislado Jerte y KX192367 - aislado Ponferrada). Más recientemente en un nuevo estudio, hemos podido recuperar las secuencias completas de dos aislados diferentes (MH300060 - aislado P8-23 y MH300061 - aislado P8-42), que estaban coinfectando un cerezo dulce (cv. Planera) de Alicante, España, con síntomas de enrojecimiento en las hojas.


Este tipo de infecciones mixtas en cerezo con diferentes genotipos de LChV-1 no habían sido descritas hasta la fecha. Ya que no existe vector conocido del virus, la coexistencia de estas variantes podría ser atribuida a prácticas agronómicas como el injerto. Estas infecciones mixtas pueden tener implicaciones en la patogenicidad del virus ya que pueden además producirse recombinaciones. La presencia de dos genotipos diferentes además sugiere dos eventos diferentes de introducción en España.
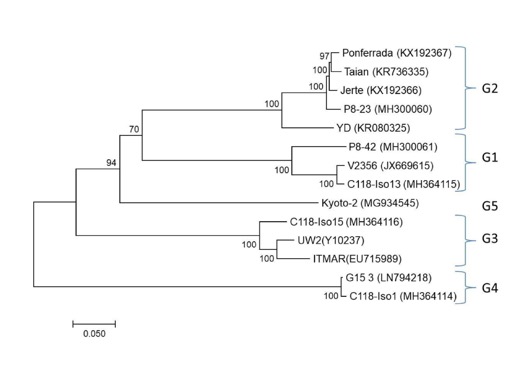
En un estudio que hemos realizado en colaboración con investigadores de Francia, Grecia y Eslovaquia, hemos logrado un avance en el conocimiento de la diversidad del virus ampliando las cuatro agrupaciones o “clusters” que se conocían a cinco. Estos avances permiten el diseño de nuevas herramientas de diagnóstico capaces de detectar todas las variantes de LChV-1 conocidas hasta el momento.
En la figura de abajo se muestra un árbol filogenético (Maximum likelihood; 500 réplicas) que relaciona las secuencias completas disponibles hasta la fecha del LChV-1.


Este tipo de infecciones mixtas en cerezo con diferentes genotipos de LChV-1 no habían sido descritas hasta la fecha. Ya que no existe vector conocido del virus, la coexistencia de estas variantes podría ser atribuida a prácticas agronómicas como el injerto. Estas infecciones mixtas pueden tener implicaciones en la patogenicidad del virus ya que pueden además producirse recombinaciones. La presencia de dos genotipos diferentes además sugiere dos eventos diferentes de introducción en España.
En un estudio que hemos realizado en colaboración con investigadores de Francia, Grecia y Eslovaquia, hemos logrado un avance en el conocimiento de la diversidad del virus ampliando las cuatro agrupaciones o “clusters” que se conocían a cinco. Estos avances permiten el diseño de nuevas herramientas de diagnóstico capaces de detectar todas las variantes de LChV-1 conocidas hasta el momento.
En la figura de abajo se muestra un árbol filogenético (Maximum likelihood; 500 réplicas) que relaciona las secuencias completas disponibles hasta la fecha del LChV-1.

De vuelta con el Grapevine pinot gris virus, y los que no disponen de PCR a tiempo real? (Autora: A.B. Ruiz-García)
18/03/20 19:11 ..... Divulgacion
Y para los que no disponen de un equipo de PCR a tiempo real? ¿cómo se puede detectar?
Pues con una RT-PCR convencional y para ello os indicamos unos iniciadores que amplifican diferentes regiones del genoma del virus.
Nuestra recomendación, al menos utilizar dos PCRs diferentes, porque este virus es variable y así disminuimos posibilidades de falsos negativos.
Iniciadores de Beuve et al.:
Proteína de movimiento (770pb)
Pg-Mer-F1 5′-GGAGTTGCCTTCGTTTACGA-3′
Pg-Mer-R1 5′-GTACTTGATTCGCCTC GCTCA-3′
Iniciadores de Glasa et al.:
5’UTR (618pb)
GPG-14F 5’-AATTGATCCCGTGTAGTGC-3’
GPG-632R 5’-TCCGAGGACGATGAACCTC-3’
Proteína de movimiento (302pb)
GPG-5637F 5’-ATTGCGGAGTTGCCTTCAAG-3’
GPG-5939R 5’-CTGAGAAGCATTGTCCCATC-3’
Proteína de cápside (411pb)
GPG-6609F 5’-GAGATCAACAGTCAGGAGAG-3’
GPG-7020R 5’-GACTTCTGGTGCCTTATCAC-3’
El protocolo para su detección por RT-PCR convencional es el siguiente:
Muestreo: 4 brotes terminales (10 cm) alrededor de la cepa
Purificación de ácidos nucleicos: RNeasy Plant kit o similar
Preparación del cóctel: Para cada reacción de 25 microlitros (3 microlitros de RNA purificado)
H2O 10,7 microlitros
Tampón 5x Promega 5 microlitros
Cl2Mg 25 mM (uso 1,5 mM) 1,5 microlitros
dNTP (2,5 mM cada uno) uso 0,25 mM 2,5 microlitros
Iniciador 1 (25 microM) uso 1microM 1 microlitro
Iniciador 2 (25 microM) uso 1microM 1 microlitros
GoTaq G2 Promega (5 U/microlitro) 0,2 microlitros
AMV Promega (10 U/microlitro) 0,1 microlitro
Condiciones del Termociclador
30 min ------------------ 45ºC
4 min ------------------- 94ºC
40 ciclos: 30 s ---------------------- 92ºC
30 s ---------------------- 50ºC
1 min -------------------- 72ºC
10 min ----------------- 72ºC
Pues con una RT-PCR convencional y para ello os indicamos unos iniciadores que amplifican diferentes regiones del genoma del virus.
Nuestra recomendación, al menos utilizar dos PCRs diferentes, porque este virus es variable y así disminuimos posibilidades de falsos negativos.
Iniciadores de Beuve et al.:
Proteína de movimiento (770pb)
Pg-Mer-F1 5′-GGAGTTGCCTTCGTTTACGA-3′
Pg-Mer-R1 5′-GTACTTGATTCGCCTC GCTCA-3′
Iniciadores de Glasa et al.:
5’UTR (618pb)
GPG-14F 5’-AATTGATCCCGTGTAGTGC-3’
GPG-632R 5’-TCCGAGGACGATGAACCTC-3’
Proteína de movimiento (302pb)
GPG-5637F 5’-ATTGCGGAGTTGCCTTCAAG-3’
GPG-5939R 5’-CTGAGAAGCATTGTCCCATC-3’
Proteína de cápside (411pb)
GPG-6609F 5’-GAGATCAACAGTCAGGAGAG-3’
GPG-7020R 5’-GACTTCTGGTGCCTTATCAC-3’
El protocolo para su detección por RT-PCR convencional es el siguiente:
Muestreo: 4 brotes terminales (10 cm) alrededor de la cepa
Purificación de ácidos nucleicos: RNeasy Plant kit o similar
Preparación del cóctel: Para cada reacción de 25 microlitros (3 microlitros de RNA purificado)
H2O 10,7 microlitros
Tampón 5x Promega 5 microlitros
Cl2Mg 25 mM (uso 1,5 mM) 1,5 microlitros
dNTP (2,5 mM cada uno) uso 0,25 mM 2,5 microlitros
Iniciador 1 (25 microM) uso 1microM 1 microlitro
Iniciador 2 (25 microM) uso 1microM 1 microlitros
GoTaq G2 Promega (5 U/microlitro) 0,2 microlitros
AMV Promega (10 U/microlitro) 0,1 microlitro
Condiciones del Termociclador
30 min ------------------ 45ºC
4 min ------------------- 94ºC
40 ciclos: 30 s ---------------------- 92ºC
30 s ---------------------- 50ºC
1 min -------------------- 72ºC
10 min ----------------- 72ºC
Un virus emergente en vid, Grapevine pinot gris virus (Autora: A.B. Ruiz-García)
01/02/20 16:03 ..... Divulgacion
Hacia el año 2004 una nueva enfermedad en vid apareció en Italia en Trentino, que producía retraso y reducción del crecimiento general de la planta, pérdida de vigor de las cepas, enanismo en sarmientos y que presentaba malformaciones en hojas y moteados cloróticos. La aplicación de la tecnología de la secuenciación masiva permitió a un grupo de investigación italiano en el año 2012 la identificación de un nuevo virus del género Trichovirus, de la familia Betaflexiviridae, asociado a cepas que presentaban síntomas de la enfermedad. El genoma del virus consiste en una molécula de ARN de polaridad positiva de entre 7223 y 7275 nucleótidos excluyendo la cola poli A en el extremo 3’ del virus. El genoma contiene tres marcos de lectura abiertos (ORF) solapantes y dos regiones no traducidas, una en el extremo 5’ y otra en el extremo 3’. El primer ORF codifica una metiltransferasa, una helicasa y la ARN polimerasa dependiente de ARN, el segundo ORF codifica la proteína de movimiento, y el tercer ORF la proteína de la cáspida.
Desde su primera descripción en Italia, el virus se ha descrito en otros países como Grecia, República Checa, Eslovaquia, Eslovenia, Francia, Alemania, Portugal, Corea del Sur, China, Canadá, EEUU, Turquía, Brasil, Croacia, Rumanía, Ucrania o Australia.
En España nuestro grupo de investigación describió por primera su presencia en el país en el año 2017, infectando variedades de Garnacha, Bobal y Tempranillo. Con el objetivo de comprender y mejorar la epidemiología de la enfermedad y desarrollar estrategias de control hemos desarrollado una RT-PCR a tiempo real que permite la detección y cuantificación del virus, con un limite de 70 copias del virus en material vegetal. También se ha aplicado a la detección en un posible vector Colomerus vitis.

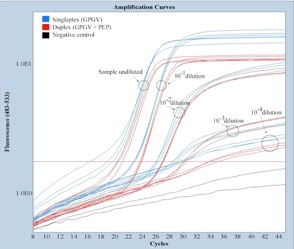
Además hemos descubierto un nuevo polimorfismo en el genoma del virus que hace que la proteína de movimiento sea más pequeña.
Un estudio filogenético basado en esta región genómica muestra una alta variaibilidad entre los aislados españoles, que se localizan en diversos grupos o “clusters” independientemente de tener o no polimorfismos en la proteína de movimiento (nuevo polimorfismo, círculo rojo completo; polimorfismo previamente descrito por un grupo italiano, círculo con sólo la circunferencia roja)
El desarrollo de esta metodología de detección y el avance en la diversidad del virus, permitirá mejorar herramientas de control y diagnóstico del virus.
Desde su primera descripción en Italia, el virus se ha descrito en otros países como Grecia, República Checa, Eslovaquia, Eslovenia, Francia, Alemania, Portugal, Corea del Sur, China, Canadá, EEUU, Turquía, Brasil, Croacia, Rumanía, Ucrania o Australia.
En España nuestro grupo de investigación describió por primera su presencia en el país en el año 2017, infectando variedades de Garnacha, Bobal y Tempranillo. Con el objetivo de comprender y mejorar la epidemiología de la enfermedad y desarrollar estrategias de control hemos desarrollado una RT-PCR a tiempo real que permite la detección y cuantificación del virus, con un limite de 70 copias del virus en material vegetal. También se ha aplicado a la detección en un posible vector Colomerus vitis.


Además hemos descubierto un nuevo polimorfismo en el genoma del virus que hace que la proteína de movimiento sea más pequeña.

Un estudio filogenético basado en esta región genómica muestra una alta variaibilidad entre los aislados españoles, que se localizan en diversos grupos o “clusters” independientemente de tener o no polimorfismos en la proteína de movimiento (nuevo polimorfismo, círculo rojo completo; polimorfismo previamente descrito por un grupo italiano, círculo con sólo la circunferencia roja)
El desarrollo de esta metodología de detección y el avance en la diversidad del virus, permitirá mejorar herramientas de control y diagnóstico del virus.
La importancia de los insectos vectores en la dipersión de los virus (Autora: A.B. Ruiz-García)
29/01/20 10:45 ..... Divulgacion
Los hemípteros son el grupo de insectos vectores más importantes en la transmisión de virus vegetales que se transmiten por insectos ya que representan más del 70% de insectos transmisores de virus. Entre ellos los pulgones y las moscas blancas transmiten más de 500 especies de virus vegetales. Enfermedades de gran impacto económico, como la enfermedad de la tristeza de los cítricos o la enfermedad de la sharka de los frutales, se transmiten por pulgón, por lo que la dispersión a corta distancia la realiza la fauna afídica de forma natural lo que puede llegar a producir grandes epidemias a nivel local. Los virus suponen un problema creciente, cada vez de mayor importancia, especialmente en las condiciones mediterráneas, que favorecen el desarrollo de sus vectores. Dependiendo del tiempo en el que el vector es virulífero y capaz de transmitir la infección, los virus se clasifican según su tipo de transmisión como persistentes, semipersistentes o no persistentes y según su ruta dentro del vector como circulativos o no circulativos. Los virus no persistentes tienen un periodo corto de retención en el estilete del áfido, el virus se transmite en las siguientes picaduras de prueba que realiza el pulgón una vez éste lo ha adquirido. Los virus semipersistentes son aquellos que se retienen por un periodo algo mayor en el estilete del vector o en su inestino anterior, aunque tampoco necesitan un periodo de latencia entre la adquisición y la transmisión. Los virus persistentes son aquellos que necesitan periodos más largos para la adquisición del virus y su transmisión, que pueden llegar a ser varios días y tienen un periodo de latencia en donde el vector tiene el virus pero no es todavía capaz de transmitirlo. Por otra parte los virus no circultativos son aquello que para su transmisión únicamente se requiere que se adhiera a cutículas de estilete o intestino anterior, mientras que los circulativos entran en sistema circulatorio del insecto y se acumulan en las glándulas salivares.
¿Qué hace interesantes los virus vegetales? (Autora: A.B. Ruiz-García)
01/01/20 17:34 ..... Opinion
Los virus vegetales tienen unas particularidades que los hacen especialmente interesantes para ser estudiados no sólo como modelo de interacción virus-vector-huésped, sino también por ser los causantes de enfermedades que tienen gran impacto económico y agronómico. Las infecciones por virus y viroides son frecuentes, y en especial, en las plantas leñosas, que permanecen durante mucho tiempo en un mismo lugar, las infecciones mixtas son algo común. Además las poblaciones de plantas cultivadas son muy homogéneas y permanecen inmóviles, por lo que si un aislado de un virus rompe la defensa natural de la planta, puede dar lugar a grandes epidemias. Los virus pueden transmitirse mecánicamente, por injerto, algunos por semilla o polen y muchos de ellos por vectores, por lo que la prevención, la erradicación y la selección sanitaria son herramientas fundamentales para el control de enfermedades producidas por virus de plantas.
 orcid.org/0000-0001-8406-7963
orcid.org/0000-0001-8406-7963